概要


医薬品中のニトロソアミン類化合物の分析
概要
当社では、医薬品(原薬、製剤、添加剤)、食品、化粧品、包装資材などに含まれるニトロソアミン不純物が管理基準以下であることを確認するための受託分析サービスを実施しています。GMP準拠、信頼性基準下での試験も対応可能です。
医薬品中のニトロソアミン不純物分析
サルタン系医薬品、ラニチジン、ニザチジン、メトホルミン等から、発がん性物質である「N-ニトロソジメチルアミン」(NDMA) や「N-ニトロソジエチルアミン」(NDEA)等のニトロソアミン類が検出され、FDAや厚生労働省をはじめとする各国規制当局は、製造販売業者に対して医薬品中のニトロソアミン類が管理基準以下であることの確認を求めています(表1)。
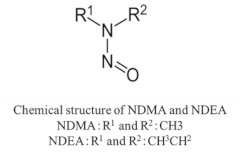
表1 各種原薬の限度値
| 分類 | 成分名 | 1日最高用量 (mg) |
NDMA限度値 (原薬中) (ppm) |
NDEA限度値 (原薬中) (ppm) |
|---|---|---|---|---|
| ARB (サルタン系医薬品) |
バルサルタン | 160 | 0.599 | 0.166 |
| イルベサルタン | 200 | 0.479 | 0.133 | |
| オルメサルタン | 40 | 2.39 | 0.633 | |
| ロサルタン | 100 | 0.959 | 0.265 | |
| H2ブロッカー | ラニチジン | 300 | 0.32 | - |
| ニザチジン | 300 | 0.32 | - |
2020年にFDAは、理論的に医薬品に含まれる可能性のある7種のニトロソアミン不純物( NDMA,NDEA,NMBA,NMPA,NIPEA,NDIPA,NDBA)を特定し、このうちの5種(NDMA,NDEA,NMBA,NMPA ,NIPEA)は、実際に原薬や製剤から検出されています。
また、2021年10月8日に厚生労働省より関連する通知「医薬品におけるニトロソアミン類の混入リスクに関する自主点検について」が出されました。EMAおよびFDAのガイダンスを参照し、下記9成分の許容摂取量が示され(表2)、さらに新規のニトロソアミン類の評価についても言及されています。
表2 各成分の許容摂取量
| ニトロソアミン類 | 許容摂取量(ng / 日) |
|---|---|
| NDMA(N-ニトロソジメチルアミン) | 96.0 |
| NDEA(N-ニトロソジエチルアミン) | 26.5 |
| NMBA(N-ニトロソ-N-メチル-4-アミノ酪酸) | 96.0 |
| NMPA(N-ニトロソメチルフェニルアミン) | 34.3 |
| NIPEA(N-ニトロソイソプロピルエチルアミン) | 26.5 |
| NDIPA(N-ニトロソジイソプロピルアミン) | 26.5 |
| MeNP(メチルニトロソピペラジン) | 26.5 |
| NDBA(N-ニトロソジブチルアミン) | 26.5 |
| NMOR(N-ニトロソモルホリン) | 127 |
FDAガイダンスにおいて、ニトロソアミン類は定量下限0.03ppm以下の分析法を用いることが求められていますが、試料によっては夾雑成分の影響を受けることがあります。
当社では、LC-MS/MS及びGC-MS/MS併用による分析条件の最適化に取り組んでおり、指定9成分の高感度分析および新規ニトロソアミン類の分析法開発に対応しています(図1、2)。
-
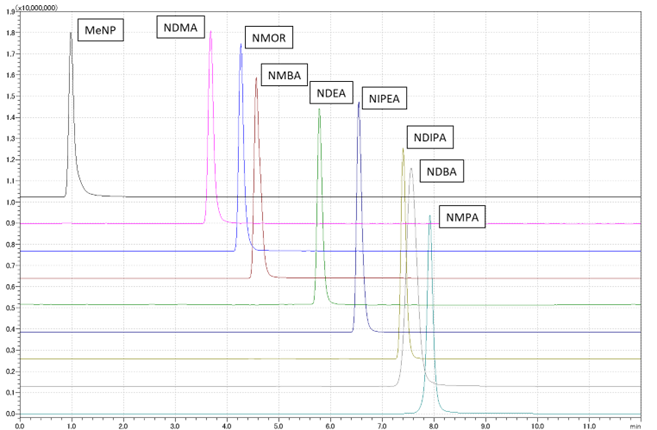
図1 LC-MS/MS 9成分一斉分析
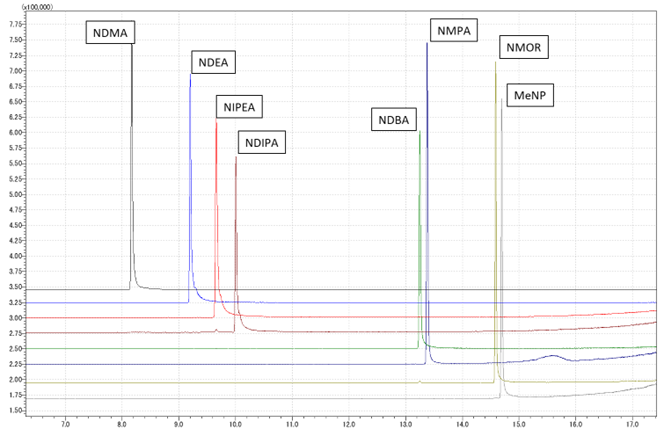
図2 GC-MS/MS 8成分一斉分析
医薬品中のニトロソアミン原薬関連不純物(NDSRIs)分析
ニトロソアミン類の混入が国内外で大きな問題となり、各国当局による規制が実施されている中で、原薬自身または原薬関連の不純物と亜硝酸類との反応(ニトロソ化)によって生成するニトロソアミン原薬関連不純物(Nitrosamine Drug Substance-Related Impurities:NDSRIs)の混入事例が報告されています。
NDSRIsは、当局の指定成分(NDMA,NDEAなど)とは異なり、原薬由来の多様な化学構造を有するため、各成分ごとに分析条件を一から構築する必要があります。
当社では、分析法の検討・開発からICH(日米EU医薬品規制調和国際会議)のガイドラインQ2およびQ2Bに準拠した分析法バリデーション、各種微量成分の高感度分析まで幅広く対応しています。
また、医薬品の品質を担保するため、温度・湿度・光などの影響下でのNDSRIsの経時モニタリング(安定性試験)にも対応しています。