概要


無菌試験
概要
無菌試験は、無菌であることが求められている原薬または製剤等の試料の無菌性を確認するための試験です。
無菌試験を実施する予備試験として、培地性能試験と手法の適合性試験が行われます。この2つの予備試験を行うことにより、本試験である無菌試験について微生物に対する検出能があることを保証できるようになります。
分析・試験方法
培地性能試験
試験に使用する培地と同ロットの培地に指標菌を接種し、微生物培養に必要な性能を有するか確認するために実施される試験。
<試験フロー>
| ・ | 無菌性 |
| 適合条件:何も添加していない培地を14日間培養し、微生物の増殖を認めないこと | |

実際の培地の写真 |
|
| 左:SCD培地 20-25℃ 右: FTG培地 30-35℃
|
|
| ・ | 好気性菌、嫌気性菌及び真菌に対する培地性能試験 |
| 指標菌を、≦100CFUとなるように培地に接種し、最大5日間培養 適合条件:微生物の増殖が肉眼で明らかに観察されること |
|
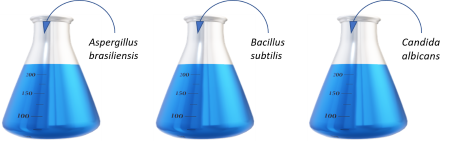
SCD培地 20-25℃ |
|

FTG培地 30-35℃ |
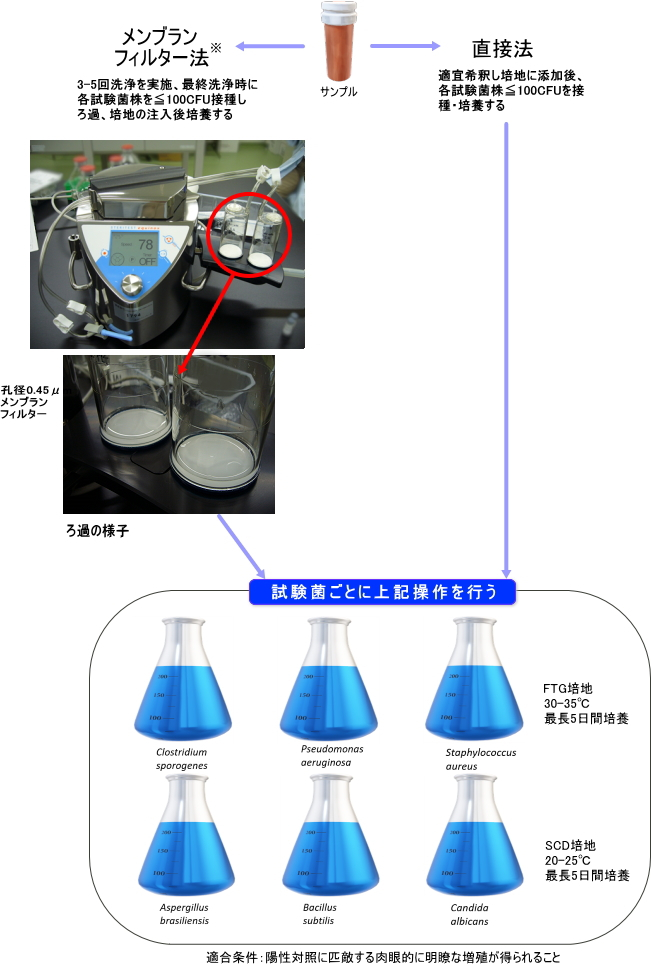
手法の適合性試験
試料に対して指標菌を接種・培養し、試験方法や試料そのものが微生物の生育に影響を与えないか確認するために実施される試験。
<試験フロー>
| ・ | 手法の適合性試験 |
| 陽性対照として培地性能試験を実施 | |
 |
|
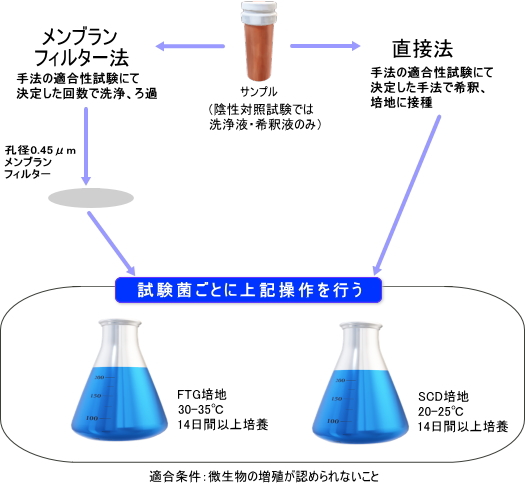
| ※ | メンブランフィルター(MF)法は検体をろ過・洗浄し検体中の微生物をMF上に集め培養することで、直接法に比べ検体が除去・洗浄されるため微生物に対する影響を低減することができる試験法です。 ただし、MFが目詰まり・破損等で正常にろ過できない検体や医療器具等の液状化できない検体では実施できません。
|
| ・ | 製品の無菌試験 |
| 試験系に微生物の汚染がないことを確認するために陰性対照試験も実施 | |
 |
● 試料量
| ・ | 検体の種類による試験に供する検体必要量(適合性確認試験・本試験) | |||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
● 実績
| ・ | 医薬品製剤、原薬、化成品など、多くの実績があります。GMP準拠、信頼性の基準下にて実施します。 |
関連情報
業務案内
微生物試験
220200106
分析・見積のご依頼・お問い合わせ
まずは、ご相談からご依頼まで、お気軽にお申しつけください。