概要


バイオ医薬品、再生医療製品中の不純物測定
概要
抗体医薬品あるいは生物由来製剤の製造工程やヒトから採取した細胞を培養して、細胞・組織等の再生医療製品を製造する際には、様々な化学物質を添加し、別の工程で精製し製品中に残留する物質濃度が安全上問題のないレベルであることを評価しなければなりません。
抗体医薬品、生物由来製剤、再生医療製品などは、測定の妨害となる多くの夾雑物(アミノ酸類,ビタミン類,血清由来タンパク,無機塩)の影響により、高感度検出が難しいことから、夾雑物を排除するための適切な前処理手法と高感度分析装置が必要です。
特徴・用途
● 特徴
- LC-MS/MS、GC-MS、HPLC(ELSD,CDD)などを使用し、残留不純物の定量が難しいと考えられる物質で多数の実績
- 高精度な定量性
- 分析法開発、予備検証試験からGMP準拠による分析法バリデーション試験及び実測定に対応
- 高感度分析における夾雑物の影響を排除する分析前処理技術
● 実績および分析用途
- 抗体医薬品(中間体、最終製品)の製造工程添加物の残留性評価
- 生物由来製剤中の揮発性成分確認
- 再生医療製品中の残留溶媒評価
- 細胞培養液中の残留溶媒評価
- 医薬品(原薬、製剤)、医薬品原料中の残留不純物、残留溶媒測定
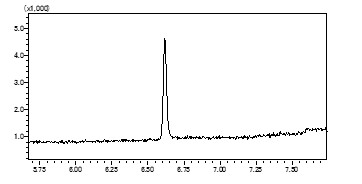
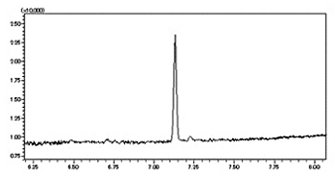
分析・試験事例
● 分析事例
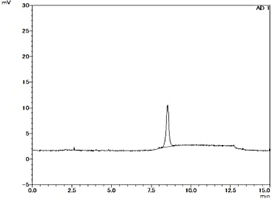
- 抗体医薬品の精製評価試験(製造工程管理)
- 再生医療製品の最終製品評価試験
- 生物由来製剤の製造工程中添加物質の残存量確認試験
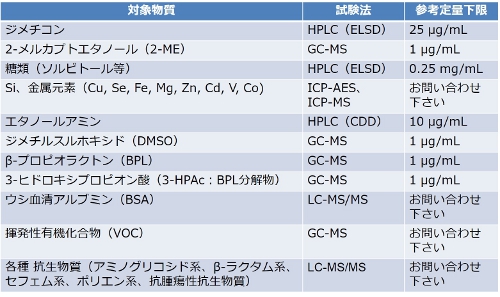
※信頼性基準下でQualification試験も実施します。
|
20201211
分析・見積のご依頼・お問い合わせ
まずは、ご相談からご依頼まで、お気軽にお申しつけください。