概要


タンパク質同定(MS/MSイオンサーチ)
概要
MS/MSイオンサーチは、電気泳動などで分離した目的タンパク質を、高感度質量分析技術とデータベース解析により同定する手法です。
目的のタンパク質を酵素処理によってペプチド断片化した後、LC-MS/MSによるペプチドの分離と質量情報の取得を行います。MS/MSデータを使用するため、 検出ペプチドが少ない場合でも信頼性の高い同定が可能になり、複数のタンパク質が存在する混合物に対しても、高いタンパク質同定率が期待されます。
● 解析の原理
|
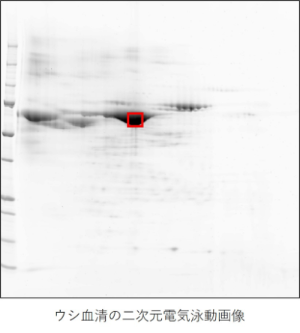
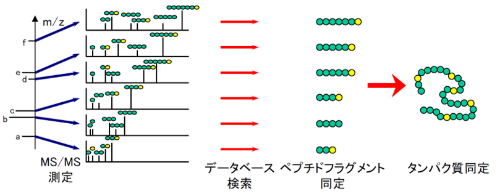
1.目的タンパク質の分離 電気泳動(SDS-PAGE、2D-PAGE)、HPLC等により分離したタンパク質を分離します。
|
 |
|
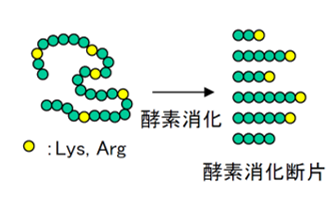
2.酵素消化によるペプチド化 通常のタンパク質は分子量が大きく、そのままでは良好なMS/MSスペクトルが得られないため、トリプシンなどの酵素処理によってペプチド断片にします。
|
 |
|
3.質量分析(MSおよびMS/MS解析) 得られたペプチド断片を質量分析により解析し、 ペプチド質量およびフラグメントイオンのスペクトルデータを取得します。LC-MS/MSを用いる場合には、分離を同時に行うので、多数のペプチドについて高精度の質量情報を得ることができます。
|
 |
| 4.データベース検索
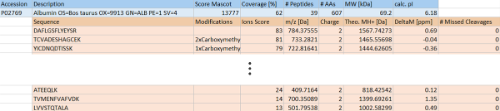
質量分析により得られたスペクトル情報をもとに、Mascotによるデータベース検索を行い、各ペプチド断片の同定とタンパク質同定を行います。
|
 |
|
1.目的タンパク質の分離 電気泳動(SDS-PAGE, 2D-PAGE)などにより、目的タンパク質を分離します。
*電気泳動による試料調製も承っております。 |
 |
|
2.酵素消化によるペプチド化 通常のタンパク質は分子量が大きく、そのままでは良好なMS/MSスペクトルが得られないため、トリプシンなどの酵素処理によってペプチド断片にします。
|
 |
|
3.質量分析(MSおよびMS/MS解析) 得られたペプチド断片を質量分析により解析し、 ペプチド質量およびフラグメントイオンのスペクトルデータを取得します。LC-MS/MSを用いる場合には、分離を同時に行うので、多数のペプチドについて高精度の質量情報を得ることができます。
|
 |
| 4.データベース検索
質量分析により得られたスペクトル情報をもとに、Mascotなどのデータベース検索を行い、各ペプチド断片の同定とタンパク質同定を行います。
|
 |
分析・試験方法
● 仕様
| ・ | ダイレクトフローnanoLCシステム Easy-nLC 1000TM (Thermo Fisher Scientific) |
| ・ | 液体クロマトグラフ質量分析計 Q Exactive Plus (Thermo Fisher Scientific) |
| ・ | 解析ソフトウェア:Proteome Discoverer (Thermo Fisher Scientific) |
| ・ | 検索エンジン:Mascot (Matrix Science Inc.) |
● サンプル関連情報
| 解析対象サンプル | : | 電気泳動(SDS-PAGE、2D-PAGE)などにより分離したタンパク質 |
| サンプル形状 | : | ゲル片、溶液、乾燥粉末 |
| 必要タンパク質量 | : | 20 fmol 以上 |
<MS/MSイオンサーチの際にご提供いただく情報>
| ・ | 生物種情報 |
| ・ | サンプル形状(ゲル片、溶液、乾燥粉末など) |
| ・ | ご提供可能なタンパク質の量(溶液の場合、タンパク質濃度もご提供ください) |
| ・ | 溶液の場合は溶液組成、乾燥品の場合は乾燥前の溶液組成 など |
*電気泳動によりサンプル調製される場合は、下記の情報もご提供ください。
| ・ | 分子量 |
| ・ | 電気泳動後の染色方法 |
| ・ | 電気泳動画像 など |
<サンプル調製時の注意事項>
| ・ | 銀染色の場合、LC-MS分析対応試薬による染色を採用して下さい。グルタルアルデヒドを用いる通常の銀染色では解析不可となります。 |
| ・ | 解析に影響を及ぼすため、ケラチンの混入には十分ご注意ください。 |
| ・ | サンプルは冷蔵または冷凍での送付をお願いします。輸送中のトラブルを避けるため、室温での送付はお控えください。 |
!ご確認ください!
関連情報
業務案内
プロテオミクス
20170929
分析・見積のご依頼・お問い合わせ
まずは、ご相談からご依頼まで、お気軽にお申しつけください。